1. Se entrega en hojas blancas.
2. Se entrega con letra clara que no se vea hecha de prisa o copiado.
3. La totalidad de las preguntas está contestada, correctamente.
4. Se entrega el día del examen , no después del examen.
5. Entregar en carpeta/folder beige,engrapadas
6. En la cara superior de la carpeta, escribir su nombre y grupo (la letra debe ser legible).
Siuna de estas condiciones no se cumple no tendrá derecho a examen
01. ¿Qué estudia la química?
02. ¿Por qué es importante la química para las sociedades modernas?
03. ¿Por qué la química está relacionada con la tecnología?
04. Explica brevemente en qué consiste el método científico y por qué es importante para la ciencia.
05. ¿Cuál es la relación entre una hipótesis y la experimentación como fase del método científico?
06. ¿Qué es un modelo y para que le sirve a los científicos?
07. ¿Cuál son las ventajas de que la química cuente con un lenguaje propio para describir los fenómenos químicos?
08. ¿Qué es la contaminación?
09. ¿Cómo se puede medir la contaminación?
12. Menciona las clases de toxicidad que existen.
10. ¿Qué es un fenómeno?
11. Describe los tipos de fenómenos.
12. ¿Qué es una sustancia pura?
13. ¿Qué es una mezcla?
14. ¿Qué es un compuesto?
15. ¿Qué es un elemento?
16. Describe los tipos de mezcla, mencionando sus características.36. Menciona las diferencias entre los compuestos y las mezclas.
17. ¿Qué enuncia la ley de la conservación de la masa?
18. ¿Quién fue Antonio L. Lavoisier?
19.- Es la ciencia que estudia la composición de la materia, sus formas, sus cambios y transformaciones.
20.- Son elementos que conforman la materia viva.
21.- Es la fuente natural de energía, necesaria para la vida de nuestro planeta.
22.- Se emplea para la fabricación de velas, cerillos, entre otros.
23.- Cuando se lleva a cabo un cambio químico se observa que las propiedades de los reactivos:
24.- La ley de la conservación de la materia establece que en todo cambio químico.
25.- Porción del espacio ocupado por un cuerpo cualquiera que puede ser sólido, líquido o gaseoso.
26.- Estado de agregación de la materia que presenta forma y volumen definidos.
27.- Propiedad de algunos sólidos de dejarse extenderse en láminas delgadas utilizando herramientas como el martillo o la laminadora.
28.-Resistencia que ofrece un sólido para que no sea penetrado.
29.- Una característica de las mezclas es que:
30.- Las mezclas heterogéneas son aquellas que:
31.- De los siguientes ejemplos, el que corresponde a una mezcla es:
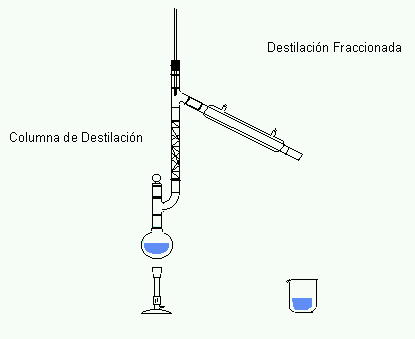
32.- El embudo de separación sirve para separar mezclas tales como:
33.- Qué método de separación utilizarías para separar agua con arena.
34.- Es un elemento muy activo, comburente e inodoro; cuando se combina con otros elementos forma óxidos.
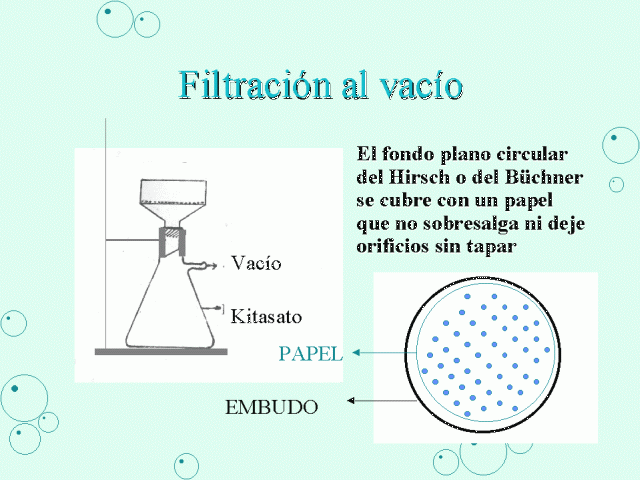
35.-Método de purificación en el cual se eliminan solidos contenidos en liquidos.
36.-El periodo de la tabla periódica representa en la configuración Electrónica
37.- Para separar una mezcla de agua y aceite que método de Separación debes utilizar
38.- Método de separación de mezclas que se utiliza para obtener los componentes de una tinta negra
39.- La particula mas pequeña de una substancia mas simple
40.- tipo de propiedad que hace que el agua pueda reaccionar con algunos oxidos
41.- Es la relación entre la masay el volumen
42.- Es la temperatura máxima a la q una sustancia permanece Como tal, ejemplo el agua a 100ªc
43.- El volumen es un ejemplo de propiedad extensiva además de el
44.- Personaje que propone un modelo del atomo de forma empíri- ca y menciona que tienen cargas subatómicas.
45.- Personaje que propone un modelo del atomo con orbitales y y los electrones girar a su alrededor
Realiza un cuadro como el que se te presenta en el ejemplo de todos los elementos de la tabla periódica solo colocando nombre y símbolo (118 elementos)
Nombre | Simbolo | Nombre | Simbolo |
cloro | Cl | Oxigeno | O |
Hidrogeno | H | nitrogeno | N |
Sodio | Na | samario | Sa |